Перспективы метода генного редактирования CRISPR для лечения врожденных заболеваний зрения
Редактирование генома становится мощным инструментом, способным устранить целый ряд генетических заболеваний. Теперь инструмент редактирования генов CRISPR/Cas9, который был разработан на основе бактериальной антивирусной защитной системы, открыл новые научные горизонты, впервые использовавшиcь непосредственно в организме живых пациентов в попытке излечить их от слепоты.
В 2017 году было проведено первое "внутричеловеческое" генетическое редактирование с использованием нуклеаз цинковых пальцев* для создания здоровой копии пораженного гена при синдроме Хантера. Генетическое редактирование с использованием нуклеаз цинковых пальцев проводилось путем изменения геномов клеток в лаборатории (ex-vivo), которые затем вводились пациенту.
Это исследование, получившее название CHAMPION, стало большим прорывом, заложившим платформу для тестирования генетического редактирования непосредственно на пациентах (in-vivo), и рассматривается всеми исследователями как важное достижение. К сожалению, результаты исследования оказались не такими хорошими, как ожидалось. Но это не ослабило интерес к генетическому редактированию in-vivo с помощью CRISPR/Cas9.
Генетические ножницы" CRISPR/Cas9 уже используются для лечения таких заболеваний, как серповидно-клеточная анемия, а также некоторых форм рака, путем генетического редактирования в условиях ex-vivo.
Последующие исследования в области редактирования генов CRISPR/Cas9 привели к первому редактированию генов в человеческом организме для лечения врожденной слепоты. Редактирование клеток происходило внутри организма (in-vivo) посредством субретинальных инъекций. Среди научного сообщества это испытание известно как BRILLIANCE. И в отличие от CHAMPION, BRILLIANCE оказалось очень успешным.
Клиническое испытание BRILLIANCE началось в 2019 году, когда EDIT-101 (экспериментальный препарат на основе CRISPR) был впервые введен взрослому человеку с генетическим заболеванием под названием врожденный амавроз Лебера тип 10 (LCA10), которое является одной из ведущих причин прогрессирующей потери зрения.
У пациентов с болезнью Лебера присутствует точечная мутация в интроне 26 (IVS26) - это наиболее распространенная мутация в гене CEP290, что приводит к функциональной потере белка CEP290. Это, в свою очередь, приводит к потере зрения из-за разрушения светочувствительных клеток сетчатки - фоторецепторов.
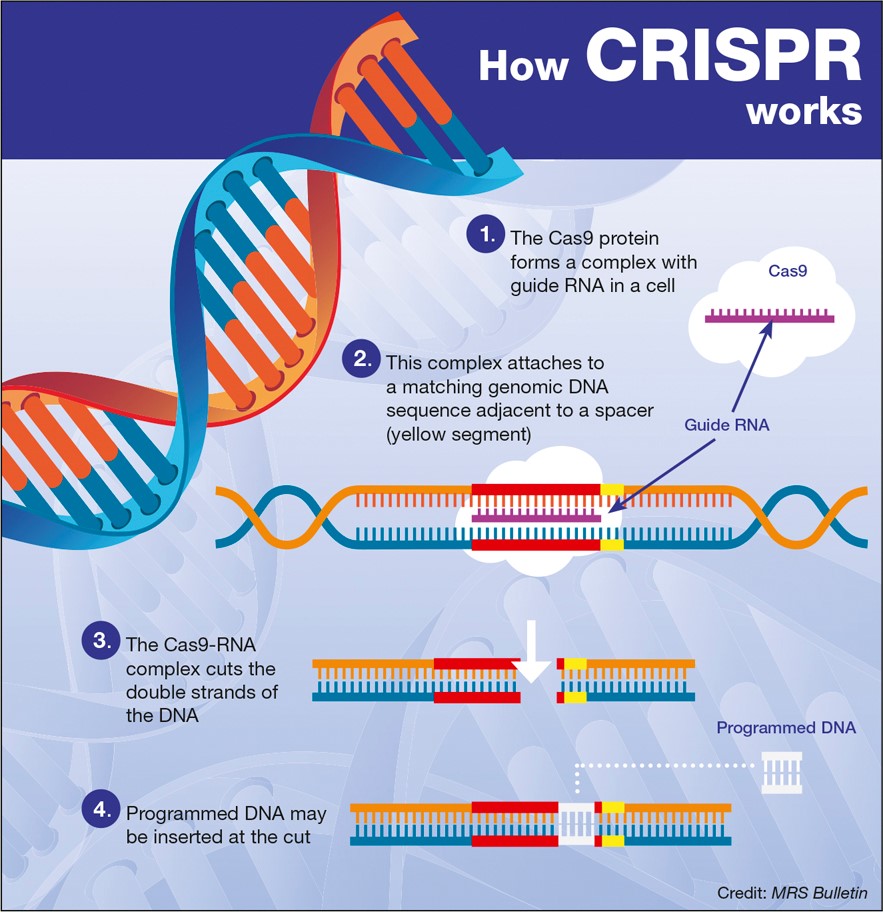
Испытание CHAMPION получило значительную поддержку благодаря исследованиям, проведенным на мутировавших клетках-предшественниках сетчатки человека, которые были выполнены в 2016 году. Эти исследования показали, что CRISPR-конструкции, специфичные для CEP20, эффективно удаляют мутацию IVS26. Это привело к принятию гипотезы о том, что CRISPR/Cas9 можно использовать in-vivo для лечения слепоты, вызванной амаврозом Лебера.
Ученые решили сосредоточиться на LCA 10, основываясь на своей теории, что пациенты с LCA имеют хорошее центральное зрение, что, в свою очередь, повысило вероятность того, что улучшение функции CEP290 с помощью генетических методов обеспечит большой терапевтический эффект. Ученые определили несколько путей, которые включали избыточную экспрессию CEP20 с помощью обычного увеличения гена и доставку полной формы гена CEP20 с помощью вируса.
Но оба эти варианта оказались неудачными. Первая методика оказалась токсичной для фоторецепторов, а вторая не могла быть применена, поскольку ген был слишком велик для переноса вирусом. Это привело к революционной идее использования CRISPR для исправления самой мутации.
Такое использование технологии CRISPR/Cas9 стало огромным шагом и уже на ранних стадиях показало явные перспективы. Исследователи рассчитывают поделиться своими первыми результатами к концу 2021 года. В случае успеха ученые откроют новую эру, когда CRISPR-cas9 будет лечить людей от слепоты путем редактирования их генов in-vivo.
* Нуклеазы цинковых пальцев — это нуклеазы, в состав которых в качестве адресующих структур входят так называемые «цинковые пальцы». Последние представляют собой белковые домены (достаточно стабильные и независимые элементы третичной структуры белка), содержащие молекулу цинка и по форме действительно напоминающие палец.
** Интроны - участки ДНК, копии которых удаляются из первичного транскрипта и отсутствуют в зрелой РНК.
Хотите больше новостей? Подпишитесь на наши новости на Facebook и Вконтакте.
Источник: Citi AM
